ΑΠΟΚΛΕΙΣΤΙΚΟ: Περνούν μέσα στις επόμενες μέρες το νόμο-δράκουλα για τα καινοτόμα φάρμακα
Νομίζετε ότι υπερβάλλουμε;
Δείτε τα στοιχεία και κρίνετε μόνοι σας:
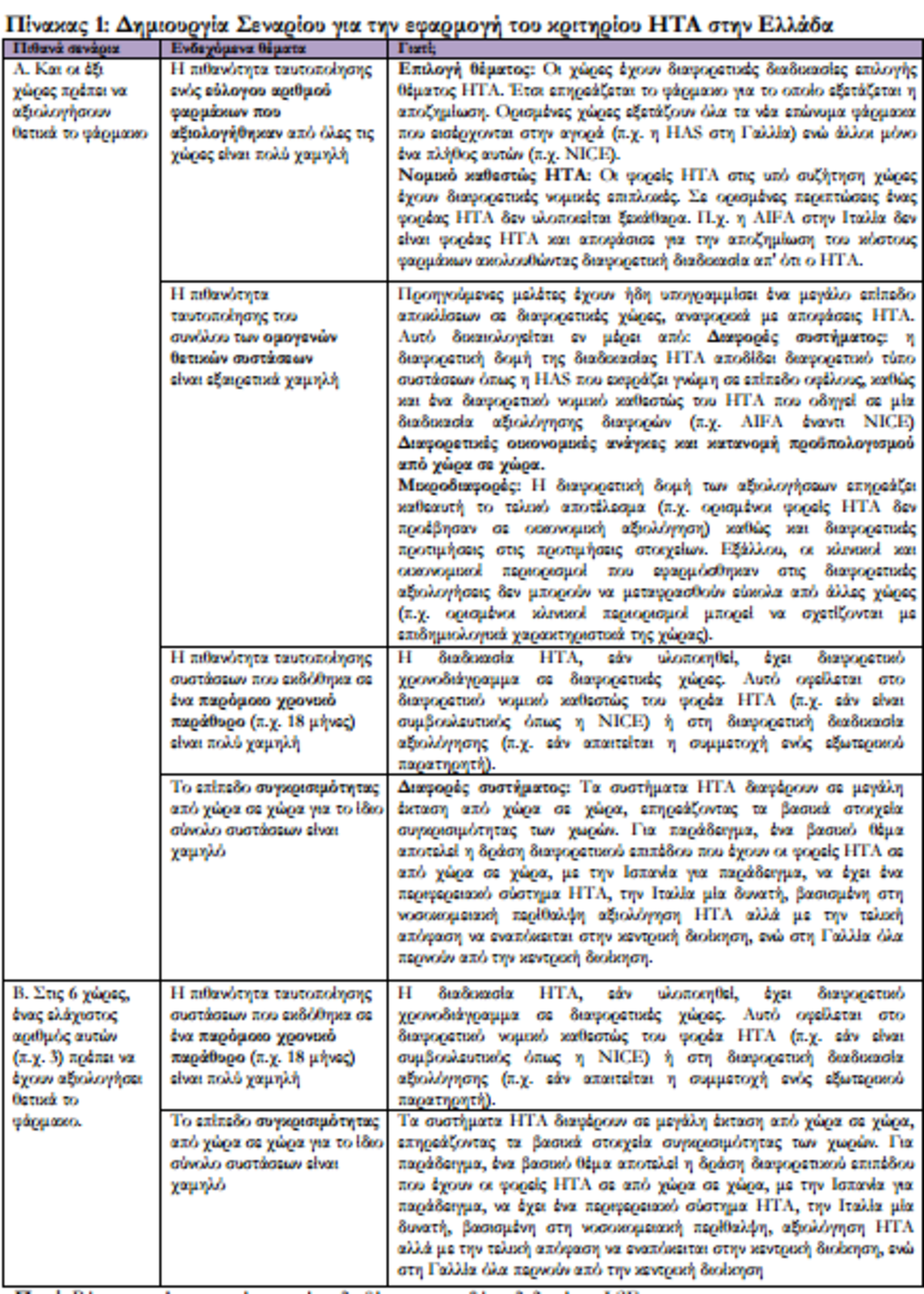
- Ο νόμος- δράκουλας προβλέπει να έχει κυκλοφορήσει το καινοτόμο φάρμακο σε 6 συγκεκριμένες χώρες της Ευρώπης που διαθέτουν σύστημα ΗΤΑ αλλά που σε κάθε χώρα το σύστημα αυτό είναι ΔΙΑΦΟΡΕΤΙΚΟ.
- Ο νόμος- δράκουλας προβλέπει 25% επιπλέον τέλος για κάθε ένα καινοτόμο φάρμακο που θα εισάγεται στην χώρα μας στην θετική λίστα (σε αυτήν που αποζημιώνει ο ΕΟΠΥΥ).
- Ο νόμος – δράκουλας προβλέπει ενοποιημένο rebate προσαυξημένο ειδικά για τα καινοτόμα φάρμακα.
- Ο νόμος- δράκουλας προβλέπει κλειστούς προϋπολογισμούς σε φάρμακα για 4 τουλάχιστον θεραπευτικές κατηγορίες, μία εκ των οποίων είναι η υπερλιπιδαιμία.
Εδικοί αναλυτικές από φαρμακευτικές επιχειρήσεις μέτρησαν κάτι απλό:
Έλαβαν ως δεδομένο ότι ψηφίζεται ο νόμος ως έχει και ότι προσπαθούν να φέρουν στην Ελλάδα τα 63 νέα φάρμακα που βγήκαν ή βγαίνουν αυτόν τον καιρό στην ευρωπαϊκή αγορά. Αν ισχύσουν τα παραπάνω 4 ως προϋποθέσεις, στην χώρα θα έρθουν μόνο 3 από αυτά τα 63 νέα φάρμακα!
Θέλετε και παραδείγματα γιατί θα συμβεί αυτό; Πάρτε δύο χαρακτηριστικά:
-Στην Ισπανία δεν βγαίνει κεντρικά απόφαση για την εισαγωγή στην αγορά ενός νέου φαρμάκου. Αυτό που συμβαίνει είναι ότι ο κεντρικός, εθνικός ΗΤΑ στέλνει γνωμάτευση στα τοπικά γραφεία του, τα αποκαλούμενα regions, τα οποία βγάζουν σε αρκετές περιπτώσεις διαφορετική απόφαση για κάθε περιοχή της χώρας αυτής. Τι θα συμβεί λοιπόν αν για ένα φάρμακο δεν συμφωνούν όλα τα ισπανικά regions; Θα λάβουμε εμείς στην Ελλάδα ως θετική ή αρνητική την Ισπανία;
-Στην Σουηδία, όταν πρόκειται για έγκριση ΗΤΑ ειδικά αντιβιοτικού, τότε κάθε μεγάλο νοσοκομείο αποφασίζει ή όχι την εισαγωγή του μεμονωμένα. Εμείς στην Ελλάδα, ποιο νοσοκομείο της Σουηδίας θα λαμβάνουμε υπόψη;
ΣΗΜΕΙΩΣΗ: Να ξεκαθαρίσουμε ότι στην πρόταση του ΥΥΚΑ αναφέρεται καθαρά ότι πρέπει ΚΑΙ στις 6 συγκεκριμένες ευρωπαϊκές χώρες να έχει εγκριθεί η κυκλοφορία ενός καινοτόμου φαρμάκου ως βασική προϋπόθεση για να κυκλοφορήσει στην χώρα μας. Και οι 6 αυτές χώρες είναι: Βρετανία, Πορτογαλία, Ισπανία, Ιταλία, Γαλλία, Σουηδία.
Κι αν οι δικές μας αποκαλύψεις και οι αναλύσεις ειδικών από την φαρμακοβιομηχανία δεν είναι επαρκείς, δείτε τι λέει στην δική του ανάλυση ο καθηγητής International Health Policy του London School of Economics and Political Science (LSE), Πάνος Καναβός, του οποίου έχουμε στα χέρια μας κατ΄αποκλειστικότητα την απάντηση. Αφού λοιπόν κάνει ένα εισαγωγικό, αναφέρει ο καθηγητής:
Πρόσθετα στα ανωτέρω, απαιτούνται διευκρινίσεις από πλευράς της κυβέρνησης για να υλοποιηθεί το κριτήριο HTA σωστά, αποφεύγοντας έτσι τυχόν σφάλματα. Αυτές αναφέρονται επιγραμματικά κατωτέρω ως έννοιες που μπορούν να τεθούν υπ’ όψιν στους φορείς που καθορίζουν την πολιτική της Ελλάδος.
Κατ’ αρχήν, δεν είναι ξεκάθαρο το νόημα της φράσης «θετική απόφαση». Υποθέτουμε ότι ένα φάρμακο χαρακτηρίζεται/αξιολογείται θετικά τόσο όταν η χρήση τουσυνιστάται πλήρως ή συνιστάται με περιορισμούς – είτε οικονομικούς ή κλινικούς. Η εν λόγω παραδοχή υιοθετήθηκε βάσει του μικρού αριθμού φαρμάκων με πλήρη θετική σύσταση που κυκλοφορούν ήδη στη χώρα καθώς και των διαφορών στον ορισμό μία «περιορισμένης» απόφασης 1σε επίπεδο χωρών. Ωστόσο, υπάρχουν πολυάριθμες υποθέσεις φαρμάκων τα οποία φορείς ΗΤΑ απέρριψαν λόγω της αδύναμης σχέσης κόστους- αποτελεσματικότητας, τα οποία όμως καλύπτονται στη συνέχεια λόγω του ότι εναλλακτικές συμφωνίες χρηματοδότησης ή ειδικοί προϋπολογισμοί έχουν δημιουργηθεί ή λόγω ύπαρξης σύμβασης επιμερισμού
κινδύνου . Μπορεί επίσης να ισχύει ότι η χρηματοδότηση είναι διαθέσιμη μόνο για ένα υποσύνολο των επιλέξιμων πληθυσμών ωστόσο όμως, αυτό αναφέρεται κατά το χρόνο που υποβάλλονται προτάσεις χρηματοδότησης. Επομένως, απαιτείται πολύ περισσότερη διασαφήνιση για το εν λόγω κριτήριο. Εκ του περισσού σου αναφέρω ότι οι παρούσες πληροφορίες για τα φάρμακα που χρηματοδοτούνται από
εναλλακτικές πηγές είναι διαθέσιμες στο ευρύ κοινό και οποιοσδήποτε τρίτος μπορεί να έχει πρόσβαση σε αυτές (ωστόσο απαιτείται κάποιου βαθμού προσπάθεια για να αναγνωρισθούν).
Δεύτερον, είναι πιο πιθανό απ’ ότι όχι, μία συγκεκριμένη τεχνολογία να λάβει εξ ολοκλήρου αντίθετες συστάσεις από διαφορετικούς φορείς HTA, έτσι ώστε σε ένα περιβάλλον να είναι αποδεκτή, σε άλλο να είναι αποδεκτή με περιορισμούς ενώ σε ένα τρίτο, να απορριφθεί. Η διαβουλευτική διαδικασία που ακολουθείται σε διάφορες χώρες καθώς και οι μεθοδολογίες που ακολουθούνται σε κάθε περιβάλλον, σε
συνδυασμό με τις εθνικές προτεραιότητες και πρόσθετα κριτήρια που μπορεί να είναι συγκεκριμένα για μία συγκεκριμένη χώρα, σημαίνει ότι θα είναι πολύ δύσκολο να έχει νόημα η αντίθεση και συχνά η αντιπαράθεση με αποφάσεις, εκτός εάν κάποιος διαθέτει το πλήρες εύρος των πληροφοριών που οδήγησαν σε αυτές.
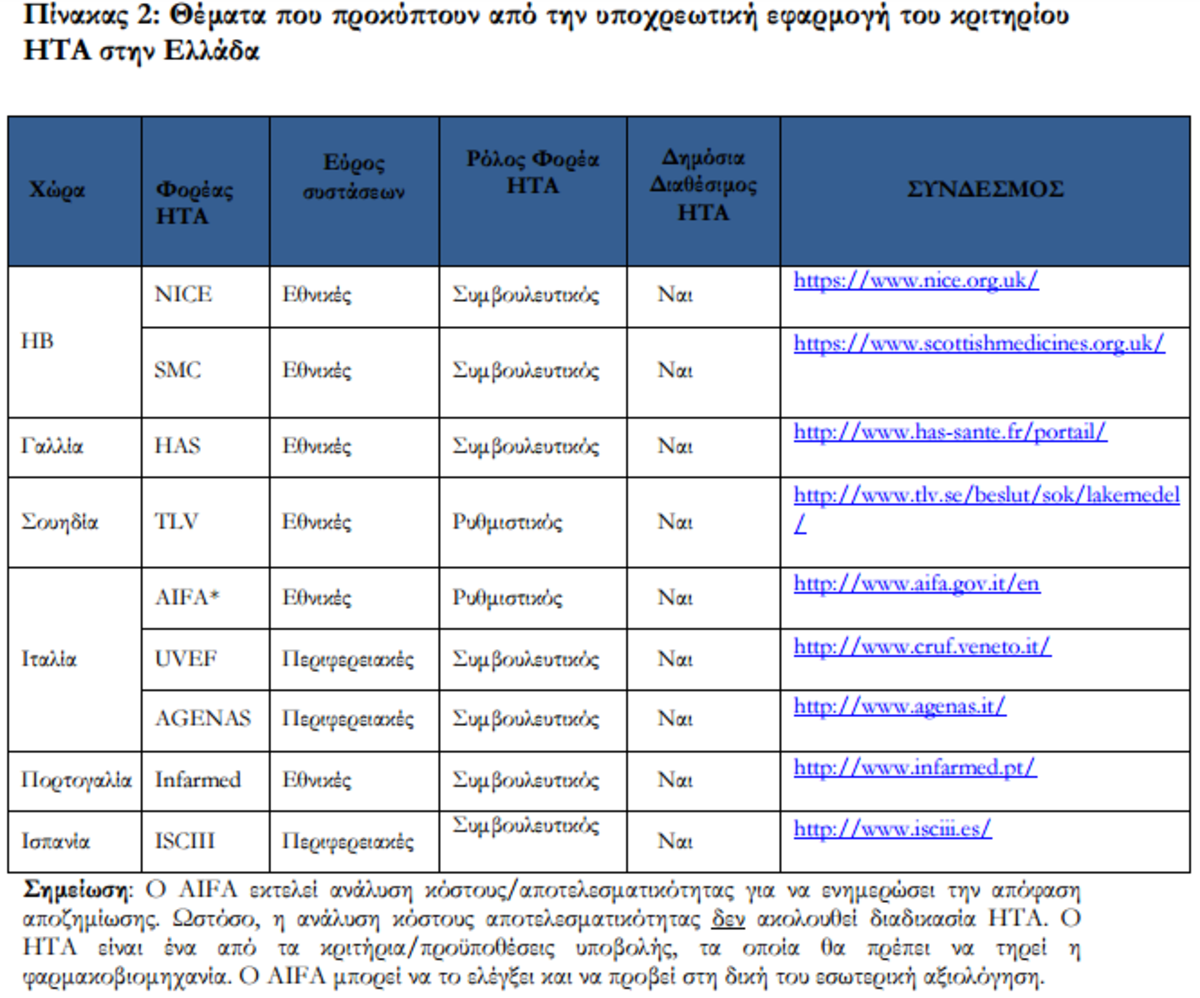
Τρίτον, είναι σημαντικό να κατανοήσουμε τους λόγους πίσω από την επιλογή των χωρών. Οι χώρες που μας ενδιαφέρουν (ΗΒ, Γαλλία, Ιταλία, Πορτογαλία, Σουηδία, Ισπανία) έχουν θεσπίσει πολύ διαφορετικές διαδικασίες και υπάρχουν σημαντικές ανομοιότητες στον τρόπο που εφαρμόζουν τον μηχανισμό HTA. Αυτό μπορεί να έχει επίπτωση στη διαθεσιμότητα των πληροφοριών και στο βαθμό στον οποίο υπάρχουν δημοσιευμένες συστάσεις που χρησιμοποιούνται για τους σκοπούς της διαμόρφωσης της πολιτικής μίας χώρας έναντι ορισμένων δημοσιευμένων αξιολογήσεων, τις οποίες
κανένας δεν λαμβάνει υπ’ όψιν. Δύο παραδείγματα αποτελούν η Ισπανία και η Ιταλία, όπου οι διαδικασίες των μηχανισμών HTA δεν υλοποιούνται με συνέπεια ούτε είναι νομικά δεσμευτικές, ενώ παραμένει ακόμα ασαφές το εάν οι συστάσεις HTA (εάν υπάρχουν) έχουν επίπτωση στις διαπραγματεύσεις σχετικά με την αποζημίωση φαρμάκων (Ισπανία) ή αποτελούν απλά τμήμα μία πιο περίπλοκης διαδικασίας (Ιταλία) για τον καθορισμό της αποζημίωσης. Σε κάθε περίπτωση, θα είναι πολύ δύσκολο να αναγνωρισθεί το εύλογο υλικό που παραπέμπει στους HTAs σε οποιαδήποτε από τις χώρες αυτές. Αυτή είναι μία από τις βασικές ανησυχίες που καθιστά την εφαρμοσιμότητα της εν λόγω μεταρρύθμισης σχεδόν αδύνατη.
Τέταρτον, οι χώρες διαφέρουν επίσης στην επιλογή των τεχνολογιών που υπάγονται στον HTA. Συχνά οι χώρες, επιλέγουν τεχνολογίες για την αξιολόγηση και εκτίμηση βάσει των εθνικών προτεραιοτήτων και άλλων τελείως διαφορετικών κριτηρίων. Μπορεί επομένως να ισχύει ότι ορισμένες τεχνολογίες δεν αξιολογούνται ποτέ από ορισμένους φορείς HTA. Θα ήταν άδικο για αυτές να λάβουν μια «αρνητική
επισήμανση» βάσει της πρότασης του Υπουργείου Υγείας.
Για παράδειγμα, η NICE στην Αγγλία αξιολογεί ένα μικρό σύνολο τεχνολογιών κάθε έτος (περίπου 30-40 κατ’ έτος) και δεν έχει τη δυνατότητα να αξιολογήσει όλες τις τεχνολογίες στο απαιτούμενο βάθος. Η TLV στη Σουηδία αξιολογεί εξωνοσοκομειακά φάρμακα μόνο και για τα ενδονοσοκομειακά φάρμακα υπάρχει μία εναλλακτική διαδικασία την οποία χειρίζονται τα Συμβούλια των Κομητειών της Σουηδίας (Swedish County Councils), όπου η TLV παρέχει επίσης πληροφορίες. Στην περίπτωση αυτή, θα ήταν
επίσης άδικο για μία νέα τεχνολογία να λάβει μια «αρνητική επισήμανση» επειδή δεν αξιολογήθηκε από μία χώρα λόγω διαδικαστικών θεμάτων.
Τέλος, ένα σημείο που σχετίζεται με το ΗΒ: το ΗΒ έχει ένα εξ ολοκλήρου αποκεντρωτικό σύστημα οργάνωσης περίθαλψης και παράδοσης και αυτό ισχύει στον ίδιο βαθμό και για τον HTA. Δεν είναι ξεκάθαρο εάν η φράση «ο HTA στο ΗΒ» αναφέρεται στον HTA στην Αγγλία, που έχει αναληφθεί από την NICE ή τη Σκωτία όπου έχει αναληφθεί από την SMC. Παρά τα προαναφερθέντα ζητήματα,
προσπάθησα να συνοψίσω τα ενδεχόμενα εμπόδια που απορρέουν από την υλοποίηση της εν λόγω πολιτικής, καθώς και να καταδείξω τα βασικά χαρακτηριστικά των διαδικασιών HTA στις έξι χώρες. Οι δύο κατωτέρω πίνακες πρέπει να διαβασθούν συνδυαστικά:
Ο Πίνακας 2 υπογραμμίζει τα βασικά θέματα που προκύπτουν από αυτή την ενδεχομένως υποχρεωτική κατάσταση και τους λόγους τους. Ο Πίνακας 3 απεικονίζει συνοπτικά τις υφιστάμενες διαφορές στη λειτουργία του HTA στις χώρες.